AbbVie
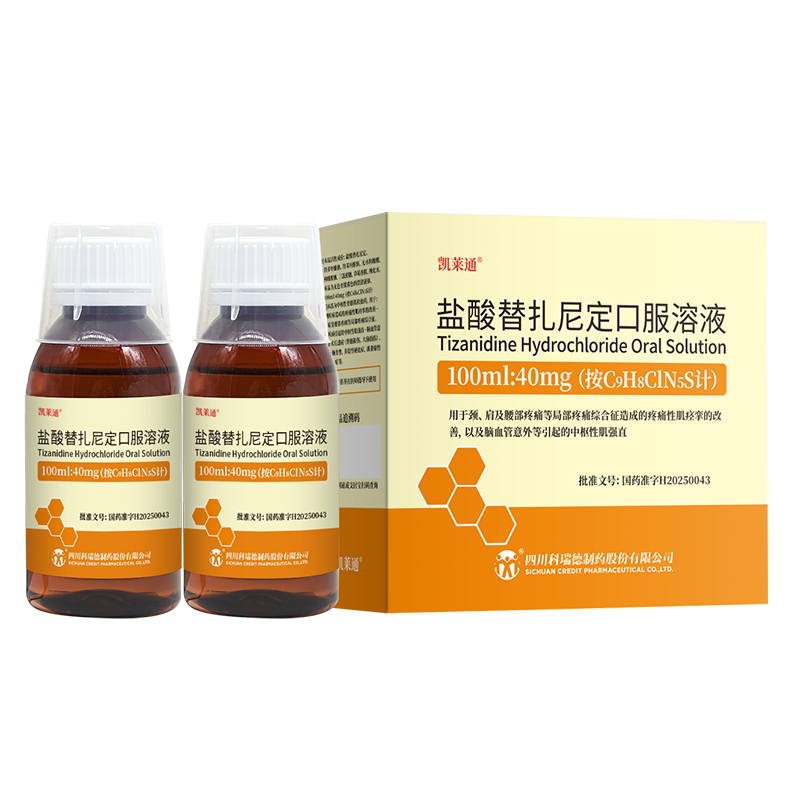
利普卓 奥拉帕利片
本品适用于:
携带胚系或体细胞 BRCA 突变的(gBRCAm 或 sBRCAm)晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌初治成人患者在一线含铂化疗达到完全缓解或部分缓解后的维持治疗。
铂敏感的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在含铂化疗达到完全缓解或部分缓解后的维持治疗。
生产企业:AbbVie Limited
通用名称:奥拉帕利片
品牌名称:利普卓
批准文号:注册证号H20180049(前往国家药品监督管理局查看)
用法用量:本品应在有抗肿瘤药物使用经验的医生的指导下使用。
BRCA 突变检测
在不同研究中已使用当地或中心实验室通过血液和/或肿瘤样本得到的 BRCA1/2 突变检测结果。根据所采用的检测方法以及国际分类共识,已将 BRCA1/2 突变归类为有害/疑似有害或致病/可能致病。
在开始使用奥拉帕利用于上皮性卵巢癌、输卵管癌或原发性腹膜癌的一线维持治疗之前,必须采用经国家药监局批准的检测方法,确认患者存在有害或疑似有害的胚系和/或体细胞 BRCA1/2 突变。
在使用奥拉帕利对含铂化疗后达到完全缓解或部分缓解的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌患者进行维持治疗之前,无需进行 BRCA1/2 突变检测。
推荐剂量
本品有 150 mg 和 100 mg 规格。
推荐剂量为 300 mg(2 片 150 mg 片剂),每日 2 次,相当于每日总剂量为 600 mg。
100 mg 片剂用于剂量减少时使用。
患者应在含铂化疗结束后的 8 周内开始本品治疗。
疗程
BRCA 突变的晚期卵巢癌的一线维持治疗:
BRCA1/2 突变晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌患者可持续治疗至疾病进展、发生不可耐受的毒性反应、或完成 2 年治疗。2 年治疗后,完全缓解(影像学无肿瘤证据)的患者应停止治疗,影像学显示有肿瘤且临床医生认为患者能从持续治疗中进一步获益的情况下可以继续治疗超过 2 年。
铂敏感的复发性卵巢癌的维持治疗:
对于铂敏感复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌患者,持续治疗直至疾病进展或发生不可耐受的毒性反应。
给药方法
口服给药。本品应整片吞服,不应咀嚼、压碎、溶解或掰断药片。本品在进餐或空腹时均可服用。
漏服
如果患者漏服一剂药物,应按计划时间正常服用下一剂量。
剂量调整
针对不良事件
为处理不良事件,比如恶心、呕吐、腹泻、贫血等,可考虑中断治疗或减量。
如果需要减量,推荐剂量减至 250 mg(1 片 150 mg 片剂,1 片 100 mg 片剂),每日服用 2 次(相当于每日总剂量为 500 mg)。
如果需要进一步减量,则推荐剂量减至 200 mg(2 片 100 mg 片剂),每日服用 2 次(相当于每日总剂量为 400 mg)。
合并使用细胞色素 P450(CYP)3A 抑制剂
在使用本品时,不推荐合并使用强效或中效 CYP3A 抑制剂,应考虑其他替代药物。如果必须合并使用强效 CYP3A 抑制剂,推荐将本品剂量减至 100 mg(1 片 100 mg 片剂),每日 2 次(相当于每日总剂量为 200 mg)。如果必须合并使用中效 CYP3A 抑制剂,推荐将本品剂量减至 150 mg(1 片 150 mg 片剂),每日 2 次(相当于每日总剂量为 300 mg)(见[注意事项]和[药物相互作用])。
特殊人群用药
肾功能损害:
轻度肾功能损害(肌酐清除率 51-80 mL/min)的患者可使用本品,且无需调整剂量;对于中度肾功能损害(肌酐清除率 31-50 mL/min)的患者,本品的推荐剂量为 200 mg(2 片 100 mg 片剂),每日 2 次(相当于每日总剂量为 400 mg);尚无本品用于重度肾功能损害或终末期肾病患者(肌酐清除率 ≤ 30 mL/min)安全性和药代动力学数据,不推荐使用本品(见[药代动力学])。
肝功能损害:
轻度或中度肝功能损害(Child-Pugh 分级 A 或 B)患者可使用本品,无需调整剂量(见[药代动力学])。尚无本品用于重度肝功能损害(Child-Pugh 分级 C)患者的安全性和药代动力学数据,不推荐使用本品(见[药代动力学])。
儿童或青少年:
尚未确立本品在儿童和青少年中的安全性和疗效,不推荐儿科患者用药。
老年人(>65 岁):
老年患者无需调整起始剂量。针对 75 岁及以上患者的临床数据有限。
利普卓 奥拉帕利片-说明书
介绍
BRCA 突变检测
在不同研究中已使用当地或中心实验室通过血液和/或肿瘤样本得到的 BRCA1/2 突变检测结果。根据所采用的检测方法以及国际分类共识,已将 BRCA1/2 突变归类为有害/疑似有害或致病/可能致病。
在开始使用奥拉帕利用于上皮性卵巢癌、输卵管癌或原发性腹膜癌的一线维持治疗之前,必须采用经国家药监局批准的检测方法,确认患者存在有害或疑似有害的胚系和/或体细胞 BRCA1/2 突变。
在使用奥拉帕利对含铂化疗后达到完全缓解或部分缓解的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌患者进行维持治疗之前,无需进行 BRCA1/2 突变检测。
推荐剂量
本品有 150 mg 和 100 mg 规格。
推荐剂量为 300 mg(2 片 150 mg 片剂),每日 2 次,相当于每日总剂量为 600 mg。
100 mg 片剂用于剂量减少时使用。
患者应在含铂化疗结束后的 8 周内开始本品治疗。
疗程
BRCA 突变的晚期卵巢癌的一线维持治疗:
BRCA1/2 突变晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌患者可持续治疗至疾病进展、发生不可耐受的毒性反应、或完成 2 年治疗。2 年治疗后,完全缓解(影像学无肿瘤证据)的患者应停止治疗,影像学显示有肿瘤且临床医生认为患者能从持续治疗中进一步获益的情况下可以继续治疗超过 2 年。
铂敏感的复发性卵巢癌的维持治疗:
对于铂敏感复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌患者,持续治疗直至疾病进展或发生不可耐受的毒性反应。
给药方法
口服给药。本品应整片吞服,不应咀嚼、压碎、溶解或掰断药片。本品在进餐或空腹时均可服用。
漏服
如果患者漏服一剂药物,应按计划时间正常服用下一剂量。
剂量调整
针对不良事件
为处理不良事件,比如恶心、呕吐、腹泻、贫血等,可考虑中断治疗或减量。
如果需要减量,推荐剂量减至 250 mg(1 片 150 mg 片剂,1 片 100 mg 片剂),每日服用 2 次(相当于每日总剂量为 500 mg)。
如果需要进一步减量,则推荐剂量减至 200 mg(2 片 100 mg 片剂),每日服用 2 次(相当于每日总剂量为 400 mg)。
合并使用细胞色素 P450(CYP)3A 抑制剂
在使用本品时,不推荐合并使用强效或中效 CYP3A 抑制剂,应考虑其他替代药物。如果必须合并使用强效 CYP3A 抑制剂,推荐将本品剂量减至 100 mg(1 片 100 mg 片剂),每日 2 次(相当于每日总剂量为 200 mg)。如果必须合并使用中效 CYP3A 抑制剂,推荐将本品剂量减至 150 mg(1 片 150 mg 片剂),每日 2 次(相当于每日总剂量为 300 mg)(见[注意事项]和[药物相互作用])。
特殊人群用药
肾功能损害:
轻度肾功能损害(肌酐清除率 51-80 mL/min)的患者可使用本品,且无需调整剂量;对于中度肾功能损害(肌酐清除率 31-50 mL/min)的患者,本品的推荐剂量为 200 mg(2 片 100 mg 片剂),每日 2 次(相当于每日总剂量为 400 mg);尚无本品用于重度肾功能损害或终末期肾病患者(肌酐清除率 ≤ 30 mL/min)安全性和药代动力学数据,不推荐使用本品(见[药代动力学])。
肝功能损害:
轻度或中度肝功能损害(Child-Pugh 分级 A 或 B)患者可使用本品,无需调整剂量(见[药代动力学])。尚无本品用于重度肝功能损害(Child-Pugh 分级 C)患者的安全性和药代动力学数据,不推荐使用本品(见[药代动力学])。
儿童或青少年:
尚未确立本品在儿童和青少年中的安全性和疗效,不推荐儿科患者用药。
老年人(>65 岁):
老年患者无需调整起始剂量。针对 75 岁及以上患者的临床数据有限。
;更多详细内容请查看下方利普卓 奥拉帕利片详细说明书。
主要成份:本品活性成分为奥拉帕利化学名称:4-(3-{[4(环丙基羰基)哌嗪-1-基]羰基}4-氟苯基)酞嗪-1(2H)-酮分子式:C24H23FN4O3分子量:434.46
用法用量:本品应在有抗肿瘤药物使用经验的医生的指导下使用。
BRCA 突变检测
在不同研究中已使用当地或中心实验室通过血液和/或肿瘤样本得到的 BRCA1/2 突变检测结果。根据所采用的检测方法以及国际分类共识,已将 BRCA1/2 突变归类为有害/疑似有害或致病/可能致病。
在开始使用奥拉帕利用于上皮性卵巢癌、输卵管癌或原发性腹膜癌的一线维持治疗之前,必须采用经国家药监局批准的检测方法,确认患者存在有害或疑似有害的胚系和/或体细胞 BRCA1/2 突变。
在使用奥拉帕利对含铂化疗后达到完全缓解或部分缓解的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌患者进行维持治疗之前,无需进行 BRCA1/2 突变检测。
推荐剂量
本品有 150 mg 和 100 mg 规格。
推荐剂量为 300 mg(2 片 150 mg 片剂),每日 2 次,相当于每日总剂量为 600 mg。
100 mg 片剂用于剂量减少时使用。
患者应在含铂化疗结束后的 8 周内开始本品治疗。
疗程
BRCA 突变的晚期卵巢癌的一线维持治疗:
BRCA1/2 突变晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌患者可持续治疗至疾病进展、发生不可耐受的毒性反应、或完成 2 年治疗。2 年治疗后,完全缓解(影像学无肿瘤证据)的患者应停止治疗,影像学显示有肿瘤且临床医生认为患者能从持续治疗中进一步获益的情况下可以继续治疗超过 2 年。
铂敏感的复发性卵巢癌的维持治疗:
对于铂敏感复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌患者,持续治疗直至疾病进展或发生不可耐受的毒性反应。
给药方法
口服给药。本品应整片吞服,不应咀嚼、压碎、溶解或掰断药片。本品在进餐或空腹时均可服用。
漏服
如果患者漏服一剂药物,应按计划时间正常服用下一剂量。
剂量调整
针对不良事件
为处理不良事件,比如恶心、呕吐、腹泻、贫血等,可考虑中断治疗或减量。
如果需要减量,推荐剂量减至 250 mg(1 片 150 mg 片剂,1 片 100 mg 片剂),每日服用 2 次(相当于每日总剂量为 500 mg)。
如果需要进一步减量,则推荐剂量减至 200 mg(2 片 100 mg 片剂),每日服用 2 次(相当于每日总剂量为 400 mg)。
合并使用细胞色素 P450(CYP)3A 抑制剂
在使用本品时,不推荐合并使用强效或中效 CYP3A 抑制剂,应考虑其他替代药物。如果必须合并使用强效 CYP3A 抑制剂,推荐将本品剂量减至 100 mg(1 片 100 mg 片剂),每日 2 次(相当于每日总剂量为 200 mg)。如果必须合并使用中效 CYP3A 抑制剂,推荐将本品剂量减至 150 mg(1 片 150 mg 片剂),每日 2 次(相当于每日总剂量为 300 mg)(见[注意事项]和[药物相互作用])。
特殊人群用药
肾功能损害:
轻度肾功能损害(肌酐清除率 51-80 mL/min)的患者可使用本品,且无需调整剂量;对于中度肾功能损害(肌酐清除率 31-50 mL/min)的患者,本品的推荐剂量为 200 mg(2 片 100 mg 片剂),每日 2 次(相当于每日总剂量为 400 mg);尚无本品用于重度肾功能损害或终末期肾病患者(肌酐清除率 ≤ 30 mL/min)安全性和药代动力学数据,不推荐使用本品(见[药代动力学])。
肝功能损害:
轻度或中度肝功能损害(Child-Pugh 分级 A 或 B)患者可使用本品,无需调整剂量(见[药代动力学])。尚无本品用于重度肝功能损害(Child-Pugh 分级 C)患者的安全性和药代动力学数据,不推荐使用本品(见[药代动力学])。
儿童或青少年:
尚未确立本品在儿童和青少年中的安全性和疗效,不推荐儿科患者用药。
老年人(>65 岁):
老年患者无需调整起始剂量。针对 75 岁及以上患者的临床数据有限。
详细说明书
温馨提示:部分商品说明书更换频繁,请以商品实物为准
请仔细阅读以利普卓 奥拉帕利片说明书并按照说明使用或在医生与药师指导下购买和使用。
| 【通用名称】 | 奥拉帕利片 |
| 【药品名称】 | 利普卓 奥拉帕利片 |
| 【主要成份】 | 本品活性成分为奥拉帕利化学名称:4-(3-{[4(环丙基羰基)哌嗪-1-基]羰基}4-氟苯基)酞嗪-1(2H)-酮分子式:C24H23FN4O3分子量:434.46 |
| 【功能主治】 | 本品适用于: |
| 【用法用量】 | 本品应在有抗肿瘤药物使用经验的医生的指导下使用。 |
| 【注意事项】 | 血液学毒性在接受本品治疗的患者中报告了血液学毒性, 包括轻度或中度(CTCAE 1 级或 2 级)贫血、中性粒细胞减少症、血小板减少症和淋巴细胞减少症的临床诊断和/或实验室检查结果。既往抗肿瘤治疗引起的血液学毒性未恢复之前(血红蛋白、血小板和中性粒细胞水平应恢复至 ≤ CTCAE 1 级), 患者不应开始本品治疗。在治疗最初的 12 个月内, 推荐在基线进行全血细胞检测,随后每月监测一次,之后定期监测治疗期间出现的具有临床意义的参数变化(见[不良反应])。如果患者出现重度或输血依赖性的血液学毒性,应中断治疗,并且应进行相关的血液学检测。如果本品给药中断 4 周后血液指标仍存在临床异常,则推荐骨髓分析和/或血细胞遗传学分析。骨髓增生异常综合征/急性髓系白血病在临床研究(包括长期生存随访)中,接受本品单药治疗的患者中骨髓增生异常综合征/急性髓系白血病( MDS/AML )的发生率<1.5% 。大多数事件的结局为死亡。在发生 MDS/AML 的患者中,奥拉帕利治疗持续时间为 < 6 个月至 > 2 年不等,更长暴露时间的数据有限。所有患者均存在导致 MDS/AML 的潜在因素,且既往均接受过铂类化疗。部分患者还接受过其它 DNA 损伤药物的治疗以及放疗。绝大多数患者为 gBRCA 1/2 突变携带者。gBRCA1 突变和 gBRCA2 突变患者中的 MDS/AML 病例发生率相似(分别为 1.7% 和 1.4%)。其中部分患者既往有肿瘤或骨髓发育不良的病史。如果奥拉帕利片治疗期间确诊患 MDS 和/或 AML,建议应停止奥拉帕利片治疗,并对患者进行适当治疗。非感染性肺炎临床研究中接受本品单药治疗的患者中,非感染性肺炎(包括结局为死亡的事件)的发生率<1.0%。所报告的非感染性肺炎临床表现不一,并受许多发病诱因(肺癌和/或肺转移癌、基础肺疾病、吸烟史和/或既往化疗和放疗史)影响。如果患者出现新的或加重的呼吸系统症状,如呼吸困难、咳嗽和发热,或胸部影像学结果异常,则暂时中断治疗,并马上开始相关检查。如果确诊为非感染性肺炎,则应停止治疗,并对患者进行适当治疗。胚胎-胎儿毒性根据本品的作用机制(聚 ADP 核糖聚合酶抑制)及动物试验,当妊娠女性服用本品时,会对胎儿造成伤害。在大鼠中进行的临床前研究显示,奥拉帕利对胚胎-胎仔生存具有不良作用。在暴露量低于推荐的人体剂量即 300 mg,每日 2 次的情况下,可诱发严重胎仔畸形。在妊娠期间不应服用本品。如果患者在服用药物期间怀孕,应告知患者本品对胎儿潜在的危害。建议告知育龄期女性在治疗期间以及最后一次服药后 6 个月内必须使用有效的避孕措施。建议告知男性患者及其育龄期女性伴侣在治疗期间以及最后一次服药后 3 个月内必须使用有效的避孕措施,并且不能捐献精子(见[孕妇及哺乳期妇女用药])。与其他药品的相互作用不推荐本品与强效或中效 CYP3A 抑制剂合并使用(见[用法用量])。如果必须合并使用强效或中效 CYP3A 抑制剂,则应减小剂量(见[用法用量])。不推荐本品与强效或中效 CYP3A 诱导剂合并使用。对于已接受本品治疗的患者,如果需要接受强效或中效 CYP3A 诱导剂治疗,开具处方的医生应意识到本品疗效可能会显著降低(见[药物相互作用])。对驾驶和操作机器能力的影响尚未进行奥拉帕利对驾驶和操作机器能力影响的研究。然而,在本品治疗期间,报告了虚弱、疲乏和头晕,出现这些症状的患者应谨慎驾驶或操作机器。对 QT 间期的影响119 名患者 300 mg 单次给药以及 109 名患者 300 mg 每日 2 次多次给药后,评估奥拉帕 利对心脏复极化的影响。未发现奥拉帕利对 QT 间期有临床相关作用。 |
| 【批准文号】 | 注册证号H20180049 |
| 【生产企业】 |
利普卓 奥拉帕利片-相关科普
更多相似功效药品推荐
更多热门药品
知名品牌
搜索热点
- 上海医药集团青岛国风药业股份有限公司
- 南京征祥医药有限公司
- 海南金泰药业有限公司
- Farmea
- 河北立生药业集团有限公司
- BSP Pharmaceuticals S.p.A.
- 上海英派药业有限公司
- 江西科睿药业有限公司
- 厦门特宝生物工程股份有限公司
- 云南先施药业有限公司
- TEEIND BIOTECHNOLOGY (HONG KONG) CO.,LIMITED
- 江苏嘉逸医药有限公司
- 珠海金鸿药业股份有限公司
- 利洁时家化(中国)有限公司
- 上海艾普愈生物医药科技有限公司
- 博福-益普生(天津)制药有限公司
- 北京华润高科天然药物有限公司
- 潍坊中狮制药有限公司
- 陕西华龙制药有限公司
- 重庆三峡云海药业股份有限公司
介绍
AbbVie Limited
2595人关注
药品推荐排行榜
更多